近年来,无论是“一致性评价”还是“4+7”带量采购,国家要将仿制药做大做强的决心,超级坚定!在通过多个政策的发布实施,以及督促企业进一步客观实际的控制仿制药质量及价格的同时,药监部门也在努力均衡着上市品种的分布状态,以满足临床所需。如今天要说的这个品种,抗HIV药物~阿扎那韦,全球销售额属重磅炸弹级别,且具有明显的治疗效果,但直至今日,国内尚无注册申报!
1.药审中心CDE~通知引导
前不久,国家药审中心CDE发布了《第二批专利权到期、终止、无效且尚无仿制申请的药品清单》,公布了7个品种“截至2018年10月前,国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市且具有明确临床价值”。其中,用于治疗和预防艾滋病的抗HIV药物硫酸阿扎那韦中国化合物专利到期日为2017/4/14,中国化合物专利号为CN1082508C;列入7品种表格首位,尚无注册申请,值得关注。
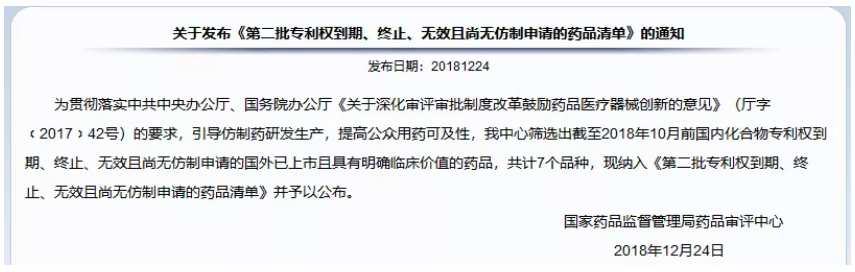
图1:《第二批专利权到期、终止、无效且尚无仿制申请的药品清单》通知
2.药物信息简介
硫酸阿扎那韦(AtazanavirSulfate),是一种HIV-1蛋白酶抑制剂,与其它抗逆转录病毒药物联合用于治疗HIV-1感染,由瑞士Novartis公司研制,之后授权给BMS。2003年6月获美国FDA批准上市,2003年12月获日本PMDA批准,2004年3月获欧洲EMA批准,商品名为Reyataz®。剂型为口服胶囊,3个规格分别为150mg、200mg或300mg。
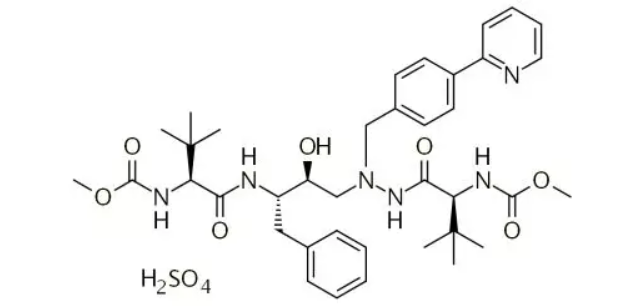
图2:硫酸阿扎那韦~化学结构
3.全球销售数据统计
从全球销售数据来看,硫酸阿扎那韦算得上重磅炸弹级别药物,2007年其销售额已超过10亿美元,不过,历年销售数据整体趋于10~20亿之间,峰值在15亿美元附近浮动,并无大幅度增长趋势,详情见下图。

图3:Reyataz®~历年销售数据统计
4.国内注册信息
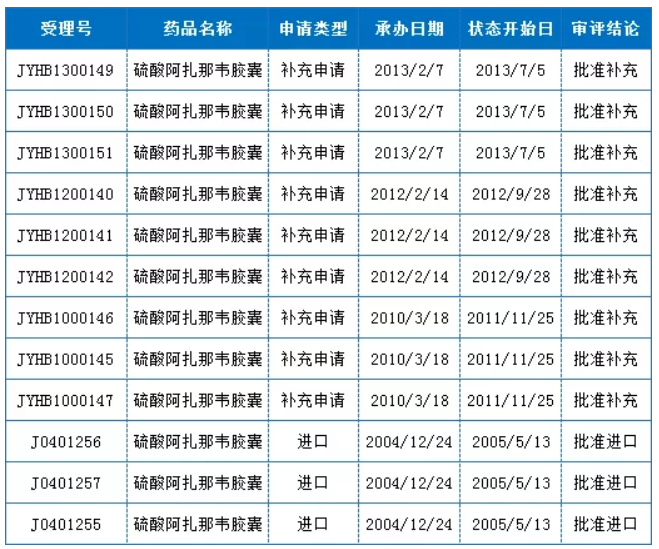
最初于美国注册上市的硫酸阿扎那韦,原研在我国已获批进口;最早的承办日期为2004年12月,申报企业为“百时美施贵宝(中国)投资有限公司”,且于2005年5月获批进口;再之后,分别于2010年、2012年、2013年申请过补充;至今,国内对于该品种尚无申报注册的仿制企业。
表1:硫酸阿扎那韦国内注册申报情况
5.合成信息
由于上市已有很长一段时间,对于硫酸阿扎那韦的合成研究,已有多个专利及文献对其进行报道,其中,下述合成路线批产量报道达公斤级,可供参考。
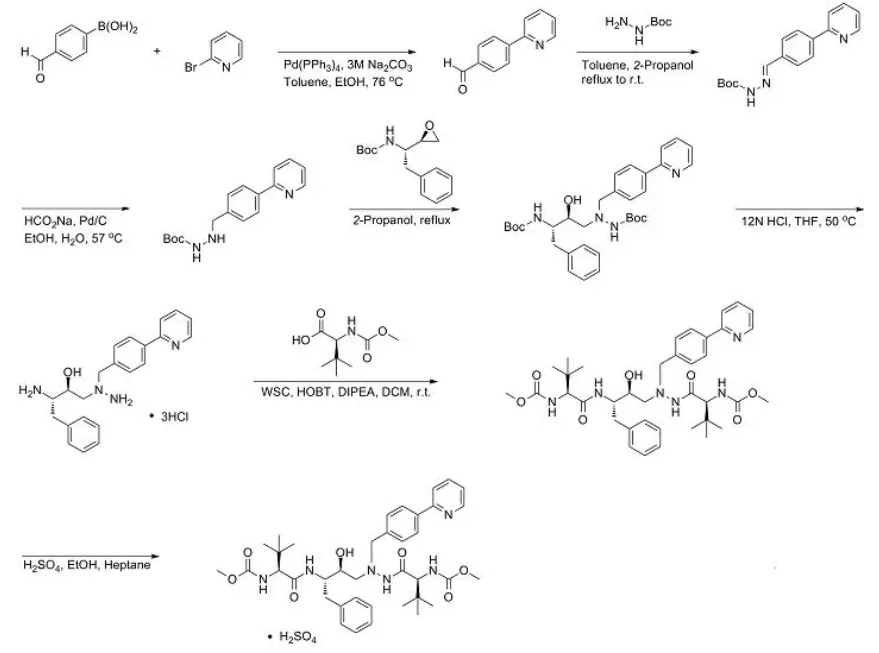
图4:硫酸阿扎那韦(合成路线之一)
6.同类药物总体发展情况
自1995年,该类药物沙奎那韦被FDA批准上市以来,已有多个HIV-1蛋白酶抑制剂被应用于临床。结构上看,除Tipranavir为非拟肽类外,其余均为拟肽类蛋白酶抑制剂。
2000年以前上市的HIV-1蛋白酶抑制剂,通常称之为第1代HIV-1蛋白酶抑制剂,在治疗艾滋病中取得了一定的效果,但由于病毒的耐药性和药物本身生物利用度低等特点,已经逐渐退出市场。
2000年以后上市的HIV-1蛋白酶抑制剂,通常称之为第2代HIV-1蛋白酶抑制剂,其对临床上已经发现的绝大部分耐药性突变毒株有很好的抑制活性,抗耐药性和生物利用度较第1代抑制剂有明显的改善。结构及部分信息见下图。
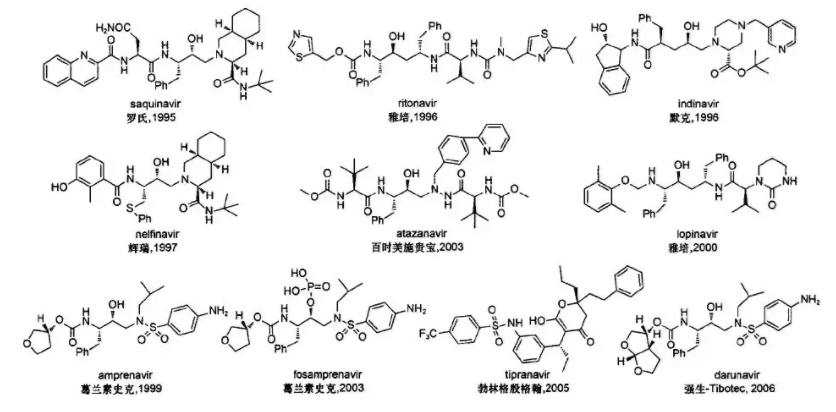
图5:已上市的HIV-1蛋白酶抑制剂
7.同类药物国内注册情况
通过逐个查询,国内药企对于以上HIV-1蛋白酶抑制剂的仿制,注册申报数量较多的品种为茚地那韦;该品种拿到生产批件的企业有浙江华海、厦门迈克、河南天方、东北制药、齐鲁制药。总体承办日期及办理状态见下图。
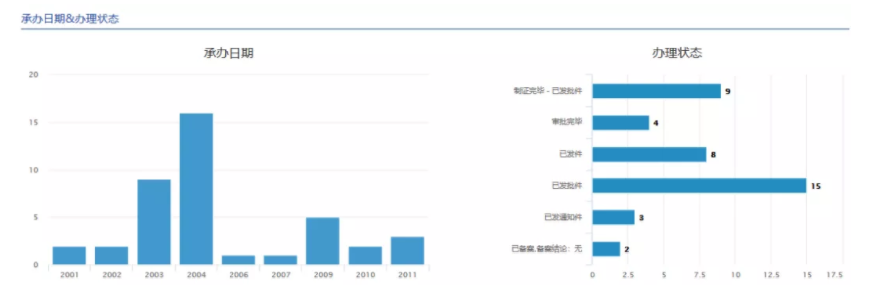
图6:茚地那韦~国内注册申报情况
8.小结
通过上述查询发现,国内企业对于HIV-1蛋白酶抑制剂的仿制开发状态,相对于肿瘤、内分泌等领域,热度相对不高,除原研外,国内注册申报企业“少且集中”!在CDE发布的《第二批专利权到期、终止、无效且尚无仿制申请的药品清单》7个品种之一,另一个HIV-1蛋白酶抑制剂替拉那韦,也是其中之一。虽然,国内药企对于该类药物的创新及仿制的热情均相对较低,但现实情况却是,我国艾滋病患者在与日俱增......而从这一点却又同时说明,国家的引导是多么的重要!
信息来源:药智新闻
声明:
本文系转载内容,版权归原作者所有,转载目的在于传递更多信息,不代表本平台观点。
如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间删除内容!
